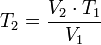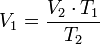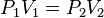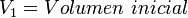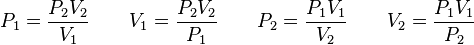Métodos De Separación De Mezclas
La destilación es la operación de separar, mediante calor, los diferentes componentes líquidos de una mezcla. Una forma de destilación, conocida desde la antigüedad, es la obtención de alcohol aplicando calor a una mezcla fermentada. El aparato utilizado para la destilación es el alambique, que consta de un recipiente donde se almacena la mezcla, a la que se le aplica calor, un condensador donde se enfrían los vapores generados, llevándolos de nuevo al estado líquido y un recipiente donde se almacena este líquido concentrado. En la industria química se utiliza la destilación para la separación de mezclas simples o complejas. Una forma de clasificar la destilación puede ser la de que sea discontinua o continua.
La decantación es un proceso físico de separación de mezcla especial para separar mezclas heterogéneas, estas pueden ser exclusivamente líquido - líquido ó sólido - líquido. Consiste en dejar reposar la mezcla hasta que por acción gravitatoria y por diferencia de densidades uno de los componentes de la mezcla se separe de ésta.
La cristalización es el proceso por el cual se forma y crece un sólido cristalino a partir de un gas o un líquido o una disolución. La cristalización es un proceso empleado frecuentemente en química a la hora de purificar una sustancia sólida
La filtración es el proceso mecánico por el cual se pueden separar mezclas de un sólido insoluble en un líquido; la separación se logra al dejar pasar el líquido a través de un material poroso, denominado filtro, el cual contiene como función retener el sólido. Los filtros más comunes son: papel filtro, fibra de asbesto, algodón, fibra de vidrio, fibras vegetales, redes metálicas, plásticas o cerámicas.
El tamizado y la sedimentación son métodos de tratamiento que preceden útilmente a la filtración para reducir la cantidad de sólidos en suspensión que entran en la fase de filtración. Esto aumenta el período en el cual el filtro puede operar antes de que necesite limpieza y sustitución. Echar el agua a través de un paño de algodón limpio eliminará una cierta cantidad de sólidos en suspensión o turbidez. Se han construido telas de filtro de monofilamento especial para uso en las zonas en las que prevalece la enfermedad del nematodo de Guinea. Las telas filtran los copépodos que son los huéspedes intermedios de las larvas del nematodo de Guineae.
La centrifugación es un método por el cual se pueden separar sólidos de líquidos de diferente densidad mediante una centrifugadora, la cual imprime a la mezcla un movimiento rotatorio con una fuerza de mayor intensidad que la gravedad, provocando la sedimentación del sólido o de las partículas de mayor densidad. La centrifugación es el método usado para separar el plasma de la sangre, para la fabricación de azúcar, separación de sustancias sólidas de la leche y en análisis químicos de laboratorio (sangre y orina).
La cromatografía engloba a un conjunto de técnicas de análisis basadas en la separación de los componentes de una mezcla y su posterior detección. Las técnicas cromatográficas son muy variadas, pero en todas ellas hay unafase móvil que consiste en un fluido (gas, líquido o fluido supercrítico) que arrastra a la muestra a través de una fase estacionaria que se trata de un sólido o un líquido fijado en un sólido. Los componentes de la mezcla interaccionan de distinta forma con la fase estacionaria y con la fase móvil. De este modo, los componentes atraviesan la fase estacionaria a distintas velocidades y se van separando. Después de haber pasado los componentes por la fase estacionaria y haberse separado pasan por un detector que genera una señal que puede depender de la concentración y del tipo de compuesto.
La evaporación es el proceso físico por el cual átomos o moléculas en estado líquido pasa al estado gaseoso, por haber tomado energía suficiente para vencer la tensión superficial. A diferencia de la ebullición, éste es un proceso paulatino, y no es necesario que toda la masa alcance el punto de ebullición. La evaporación es un fenómeno importante e indispensable en el ciclo de la vida. El más conocido: el del agua, que se transforma en nube y vuelve en forma de lluvia, nieve o rocío, necesita esta etapa. Cuando existe un espacio libre encima de un líquido calentándose, una fracción de sus moléculas está en forma gaseosa, al equilibrase, la cantidad de materia gaseosa define la presión de vapor saturante, la cual depende de la temperatura. Si la cantidad de gas es inferior a la presión de vapor saturante, una parte de las moléculas pasan de la fase líquida a la gaseosa: eso es la evaporación.
La sublimación es un proceso físico que consiste en el cambio de estado de la materia gaseosa al estado sólido, sin pasar por el estado líquido. Antiguamente también se llamaba de la misma forma al proceso inverso, la volatilización. Un ejemplo clásico es el hielo seco.









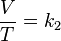
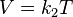
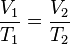
 = Volumen inicial
= Volumen inicial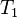 = Temperatura inicial
= Temperatura inicial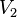 = Volumen final
= Volumen final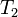 = Temperatura final
= Temperatura final