Ley De Charles y Gay-Lussac
La Ley de Charles y Gay-Lussac, o simplemente Ley de Charles, es una de las leyes de los gases.
Relaciona el volumen y la temperatura de una cierta cantidad de gas ideal, mantenido a una presión constante,
mediante una constante de proporcionalidad directa.
Relaciona el volumen y la temperatura de una cierta cantidad de gas ideal, mantenido a una presión constante,
mediante una constante de proporcionalidad directa.
En esta ley, Jacques Charles dice que para una cierta cantidad de gas a una presión constante, al aumentar la
temperatura, el volumen del gas aumenta y al disminuir la temperatura el volumen del gas disminuye. Esto se
debe a que la temperatura está directamente relacionada con la energía cinética (debido al movimiento) de las
moléculas del gas. Así que, para cierta cantidad de gas a una presión dada, a mayor velocidad de las moléculas
(temperatura), mayor volumen del gas.
temperatura, el volumen del gas aumenta y al disminuir la temperatura el volumen del gas disminuye. Esto se
debe a que la temperatura está directamente relacionada con la energía cinética (debido al movimiento) de las
moléculas del gas. Así que, para cierta cantidad de gas a una presión dada, a mayor velocidad de las moléculas
(temperatura), mayor volumen del gas.
La ley fue publicada primero por Gay Lussac en 1803, pero hacía referencia al trabajo no publicado de Jacques
Charles, de alrededor de 1787, lo que condujo a que la ley sea usualmente atribuida a Charles. La relación
había sido anticipada anteriormente en los trabajos de Guillaume Amontons en 1702.
Charles, de alrededor de 1787, lo que condujo a que la ley sea usualmente atribuida a Charles. La relación
había sido anticipada anteriormente en los trabajos de Guillaume Amontons en 1702.
Por otro lado, Gay-Lussac relacionó la presión y la temperatura como magnitudes directamente
proporcionales en la llamada "La segunda ley de Gay-Lussac".
proporcionales en la llamada "La segunda ley de Gay-Lussac".
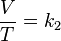
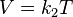
- V es el volumen.
- T es la temperatura absoluta (es decir, medida en Kelvin).
- k2 es la constante de proporcionalidad.
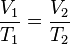
 = Volumen inicial
= Volumen inicial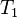 = Temperatura inicial
= Temperatura inicial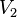 = Volumen final
= Volumen final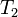 = Temperatura final
= Temperatura final
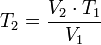
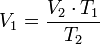

donde:
Además puede expresarse como:
donde:
Despejando T₁ se obtiene:
Despejando T₂ se obtiene:
Despejando V₁ es igual a:
Despejando V₂ se obtiene:





0 comentarios:
Publicar un comentario