Ley de Boyle-Mariotte
Históricamente hablando, se puede afirmar que los gases fueron las primeras sustancia que permitieron la formulación de leyes sencillas para explicar sus propiedad y comportamiento al ser sometidos a diversas variaciones de presión, volumen o de temperatura.
Unos de los pioneros de la experimentación con gases fue el químico ingles Robert Boyle, quien en 1660, y al mismo tiempo que Edme Mariotte, trabajando independientemente uno del otro descubrió la relación entre la presión y la temperatura. Tras una serie de trabajos tratando de hallar alguna relación entre el volumen y la presión de un gas manteniendo la temperatura constante, Boyle llego a las siguientes conclusiones:
Al duplicar la presión de una masa de gas enserada en un cilindro en un embolo, el volumen se producía a la mitad, mientras que si se ejercía una presión tres veces mayor, el volumen disminuía a una tercera parte del valor original, y ha si sucesivamente.
Boyle resumio sus resultados en la ley que lleva su nombre: el volumen de una determinada masa de gas, a temperatura constante, es imversamente proporcinal a la precion de ese gas.

donde  es constante si la temperatura y la masa del gas permanecen constantes.
es constante si la temperatura y la masa del gas permanecen constantes.
 es constante si la temperatura y la masa del gas permanecen constantes.
es constante si la temperatura y la masa del gas permanecen constantes.
Cuando aumenta la presión, el volumen baja, mientras que si la presión disminuye el volumen aumenta. No es necesario conocer el valor exacto de la constante  para poder hacer uso de la ley: si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
para poder hacer uso de la ley: si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
 para poder hacer uso de la ley: si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
para poder hacer uso de la ley: si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación: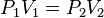
donde:


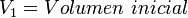

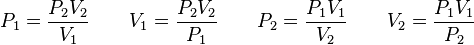

Esta ley es una simplificación de la ley de los gases ideales o perfecto particularizada para procesos isotérmicos de una cierta masa de gas constante.
Junto con la ley de Charles, la ley de Gay-Lussac, la ley de Avogadro y la ley de Graham, la ley de Boyle forma las leyes de los gases, que describen la conducta de un gas ideal. Las tres primeras leyes pueden ser generalizadas en la ecuación universal de los gases.



0 comentarios:
Publicar un comentario